ПОДГОТОВКА: Разработка Протокола и других документов исследования. Подбор медицинских центров и исследователей̆. Получение разрешения от Минздрава РФ и этических комитетов.
Клинические исследования
лекарственных препаратов с участием человека
Это обязательный этап оценки их эффективности и безопасности перед государственной регистрацией и появлением на полках аптек.
Клинические исследования проводятся с разрешения Минздрава РФ и Независимых Этических Комитетов, с соблюдением законодательства и правил Надлежащей Клинической Практики.
В России ежегодно проводится около 700 клинических исследований лекарственных препаратов, организуемых 150 фармацевтическими компаниями. В них участвуют около 60 000 пациентов и здоровых добровольцев.
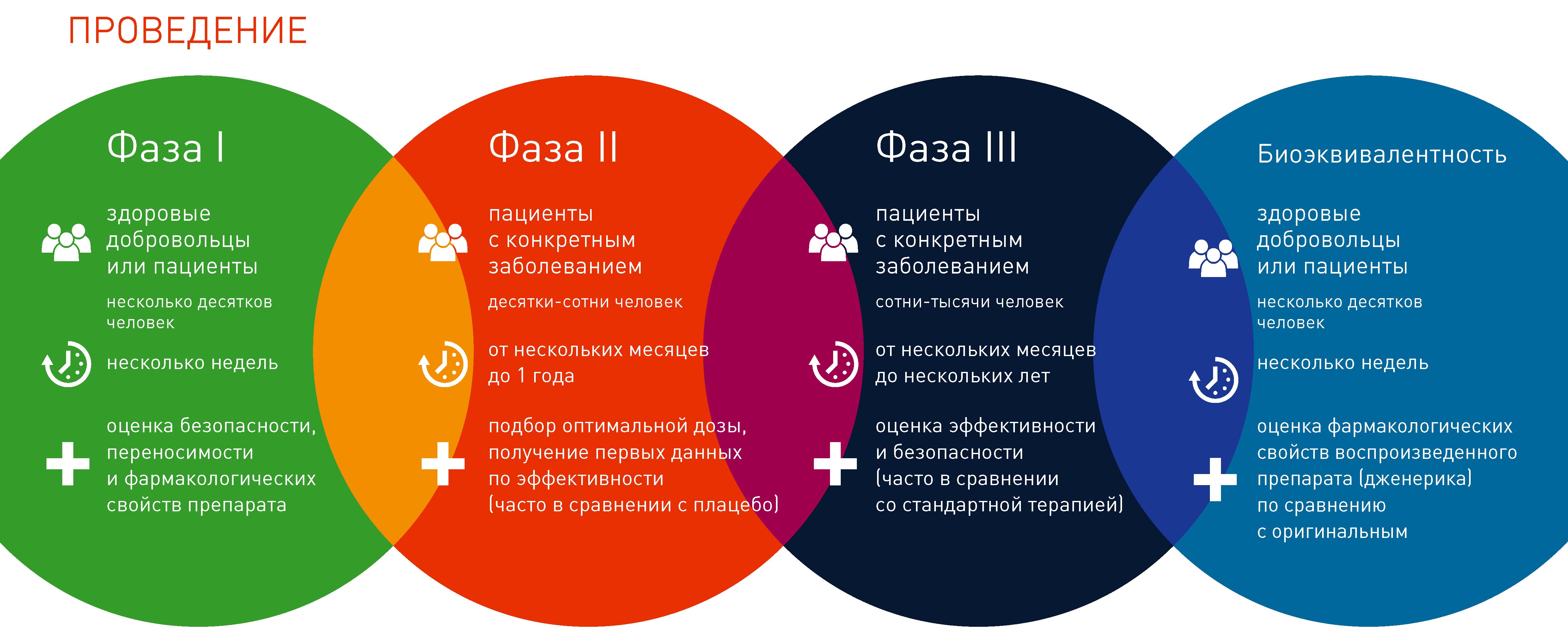
Как проходят клинические исследования новых лекарственных препаратов с участием человека:
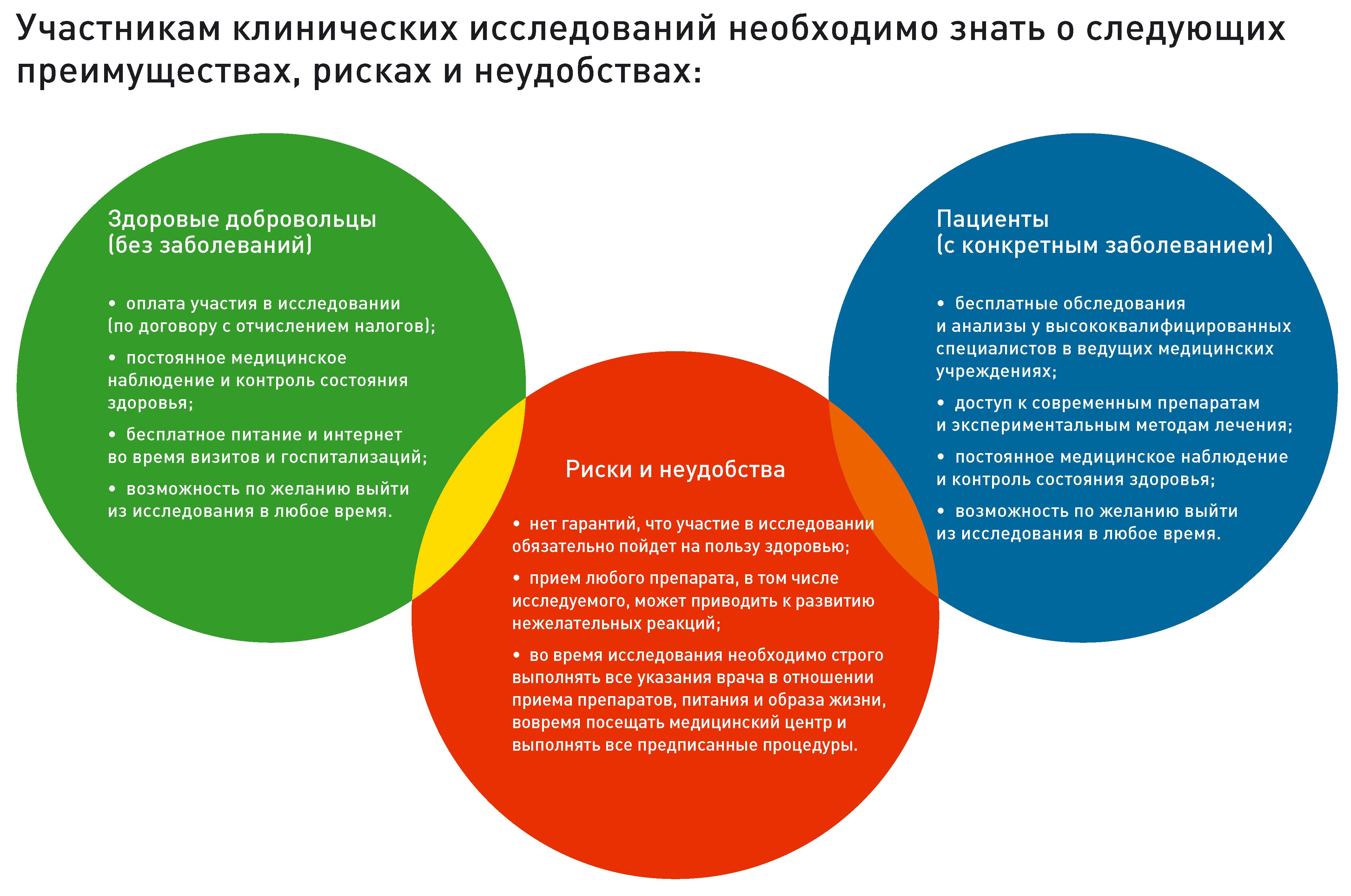
- Участником клинического исследования может стать пациент с конкретным заболеванием или здоровый доброволец, соответствующий утвержденным критериям.
- Участие в исследовании добровольно; решение принимается самим участником после предоставления ему исчерпывающей̆ и понятной̆ информации и документируется в письменном виде (форма информированного согласия).
- Участие в клинических исследованиях бесплатно (не требует оплаты со стороны участников).
- Жизнь и здоровье участников клинических исследований застрахованы согласно законодательству РФ.
АНАЛИЗ ДАННЫХ
- Сбор, проверка и обработка полученных данных (личность и персональные данные участников исследования не раскрываются)
- Подготовка отчета по результатам исследования
ЧТО ДАЛЬШЕ
- Завершение клинической разработки исследуемого препарата или переход на следующую фазу
- Государственная регистрация нового лекарственного препарата
- Пострегистрационные исследования и сбор данных об эффективности и безопасности применения лекарств в реальной клинической практике (Фаза IV, Наблюдательные исследования)
Клинические исследования напрямую влияют на развитие медицинской науки и здравоохранения в современном мире. Данные, полученные в результате исследований, становятся основой для разработки новых стандартов лечения и борьбы с серьезными заболеваниями.
